SEMANA 3
Ley del Gas Ideal
n de gas ideal, las moléculas no tienen volumen y no hay interacción entre ellos. En términos reales, no hay un gas, es sólo una suposición. Todos los gases reales se ha de pequeños volúmenes y hay interacciones entre ellos. En solución de problemas; asumimos todos los gases como el gas ideal. Ecuación dada a continuación es la ley del gas ideal. Lo conseguimos mediante la combinación de todas las leyes de los gases en la sección anterior.
P.V=n.R.T
Donde, P presión, volumen V, n el número de partículas, R constante de los gases 0,08206 L atm / mol K o 22,4 / 273 L atm / mol K, y T la temperatura
Ahora que resolver algunos problemas relacionados con la ley del gas ideal para una mejor comprensión, se suceden ejemplo atentamente.
Ahora que resolver algunos problemas relacionados con la ley del gas ideal para una mejor comprensión, se suceden ejemplo atentamente.
Ejemplo: Buscar la presión de 8,8 g de CO2 a 27 0C en un recipiente con volumen 1230 cm3. (C = 12, O = 16)
Solución: En primer lugar, encontrar la masa molar de CO2;
CO2=12+2.16=44
Entonces, nos encontramos con moles de CO2;
n = 8,8 / 44 = 0,2 moles
Convertir la temperatura de 0 ° C a K y el volumen de cm3 a litro;
T=27+273=300 K
Solución: En primer lugar, encontrar la masa molar de CO2;
CO2=12+2.16=44
Entonces, nos encontramos con moles de CO2;
n = 8,8 / 44 = 0,2 moles
Convertir la temperatura de 0 ° C a K y el volumen de cm3 a litro;
T=27+273=300 K
V=1230 cm3=1,23 litros
Ahora, usamos la ley del gas ideal para encontrar la cantidad desconocida.
P.V=n.R.T
Ahora, usamos la ley del gas ideal para encontrar la cantidad desconocida.
P.V=n.R.T
P.1,23=0,2.0,08206.300
P=4 atm
Ejemplo: Encontrar la masa molar de X (gas) que figura en el cuadro de abajo con 896 cm3 de volumen, temperatura de 273 °C y la masa de 0,96 g. (O = 16, y la presión atmosférica es de 1 atm)
solución:
Hacemos conversiones de unidades en primer lugar.
P=38 cm Hg=38/76=0,5 atm
Hacemos conversiones de unidades en primer lugar.
P=38 cm Hg=38/76=0,5 atm
V=896/1000=0,896 litros
T=273 + 273=546 K
Ahora, usamos la ley del gas ideal para encontrar n;
P.V=n.R.T
Ahora, usamos la ley del gas ideal para encontrar n;
P.V=n.R.T
0,5.0,896=n.(22,4/273).546
n=0,03 moles
La masa molar de X;
MX=mX/n=0,96/0,03
MX=32 g/mol
Así ; X(gas)=O2
Ley de Avogadro:
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen
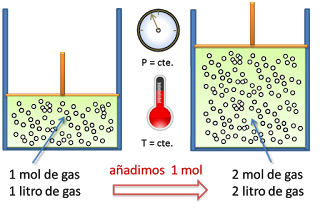
Ejemplo
sean 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
V1 / n1 = V2 / n2
V1 = 2 litros
n1 = 0,5 moles
n2 = 0,5 + 1 = 1,5 moles
V2 = V1 · n2 / n1 = 2 · 1,5 / 0,5 = 6 litros

Comentarios
Publicar un comentario